新聞與活動
探索尚博生物科技的最新動態、技術新知與產業活動

活動報導
2025年8月5日
尚博生物科技參與 2025 BioAsia 亞洲生技大展
感謝大家的熱情參予,許多同業都來造訪我們的攤位並與國外專家進行對談;經過我們同仁的解說,讓大家了解到尚博生技....
閱讀更多 →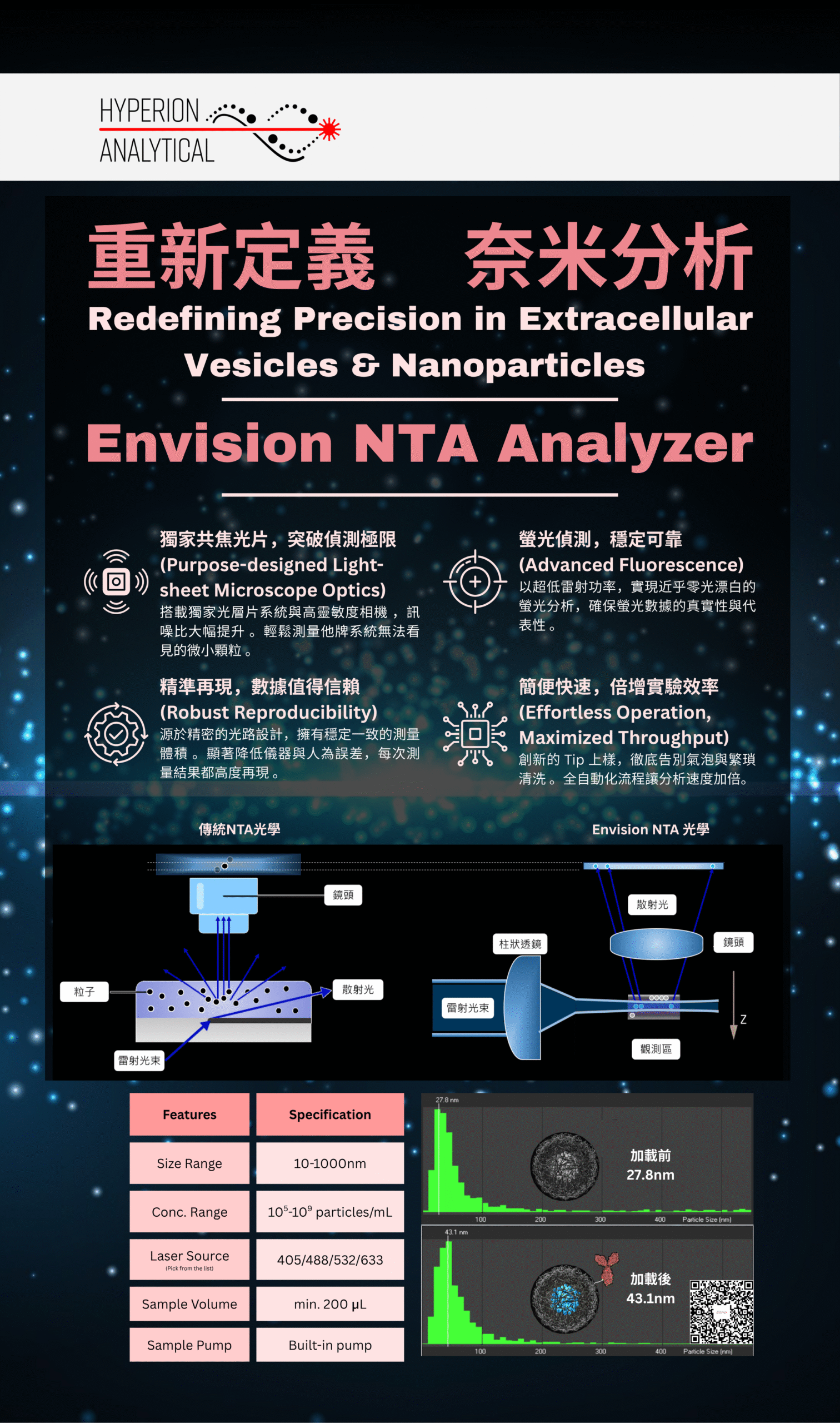
技術新知
2025年7月22日
重新定義 奈米分析:Envision NTA Analyzer
次世代光層片NTA 分析儀,透過獨特的光學設計,大幅提升奈米顆粒分析的精準度與敏感度;Build-in pump 避免手動注入樣本所造成的誤差...
閱讀更多 →
公司新聞
2025年6月15日
尚博生物科技正式推出客製化實驗室代檢服務 (CRO)
為了更好地服務廣大科研社群,我們正式啟動 CRO 代檢服務。憑藉我們頂級的技術平台與專業團隊,我們將能協助您加速研發進程...
閱讀更多 →